식약처, 품목갱신제도 첫 5년간 결과 공개…60% 갱신
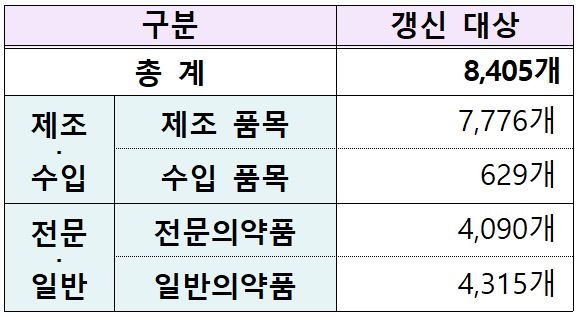
메디칼타임즈=허성규 기자식품의약품안전처(처장 오유경)는 의약품 품목허가 유효기간(5년)을 부여해 안전성과 유효성을 주기적으로 점검하고 효율적으로 관리하기 위한 '의약품 품목갱신 제도' 시행('18년~) 이후 '첫 5년간('18~'23.6.) 의약품 품목갱신 총괄 운영 결과'와 '2023년 의약품 품목갱신 결과'를 공개한다고 밝혔다.의약품 품목 갱신 제도는 이미 허가·신고된 의약품에 대한 주기적, 체계적인 사후관리 및 소비자 공급 품목 중심으로 안전관리를 집중하기 위해 2018년부터 본격 시행되었으며, 2023년 6월에 첫 5년간('18~'23.6) 품목갱신 운영이 마무리됐다.해당 기간에 의약품 총 39,538개 품목 중 15,979개 품목(40%)이 정리되고, 23,559개 품목(60%)이 갱신됐는데, 이는 업계에서 실제 유통되는 의약품을 중심으로 관리 역량을 집중했기 때문으로 분석했다.또한 갱신 대상(39,538개 품목) 중 64%가 전문의약품(25,313개 품목)이었으며, 전문의약품은 70%(17,649개 품목), 일반의약품은 42%(5,910개 품목)가 갱신돼 국내 의약품 시장은 전문의약품 비중이 높은 것으로 확인됐다. 또한 분야별로는 비교적 최근에 허가받은 품목이 많은 생물의약품의 갱신율이 73%로 가장 높았다.식약처는 첫 5년간 품목갱신 과정 중 최신 안전성과 유효성 등 의약품의 안전 정보를 반영해 '아스피린' 제제(해열·진통제) 등 143개 성분, 2,604개 품목의 허가사항 변경 등 안전조치를 실시했다.이중 지난 2023년 갱신 대상 의약품은 총 6,562개 품목이며, 이 중 1,751개 품목(27%)이 정리되고 4,811개 품목(73%)이 갱신됐다.2023년 갱신율(73%)은 지난 5년간('18∼'22) 평균(59%)보다 높은 수준으로, 특히 2023년 하반기는 84%로 확인됐다.이는 첫 5년간('18-'23.6.) 품목갱신이 완료되고 2023년 하반기부터 두 번째 5년간('23.7.-'28.6.)의 품목갱신이 시작됨에 따라 갱신율이 높아진 것으로 판단했다.식약처는 지난해 혐기성 균 감염 등에 사용되는 '메트로니다졸' 주사제의 용법‧용량을 소아와 미숙아로 구분하여 설정하는 등 의약품 15개 성분, 88개 품목의 허가사항을 변경했으며, '설글리코타이드' 정제(위·십이지장궤양약) 등 총 2개 성분, 2개 품목에 대해 재평가를 진행하고 있다.식약처는 의약품 품목갱신 정보가 유통 중 의약품 현황 파악 및 개발·출시 전략 수립에 도움을 줄 것으로 기대하며, 앞으로도 최신 의약품 안전 정보를 반영하여 주기적·체계적으로 의약품을 철저하게 관리할 계획이다.한편 '2023년도 의약품 품목갱신 보고서'는 식약처 누리집 (mfds.go.kr) → 법령/자료 → 자료실 → 안내서/지침에서 확인이 가능하다.